что такое аспирация околоплодными водами
Синдром аспирации мекония
Синдром аспирации мекония – состояние острой дыхательной недостаточности вследствие внутриутробного попадания в легкие ребенка мекониальных масс с закупоркой просвета бронхов. Характерен синюшный оттенок кожи с рождения, тяжелое шумное дыхание с западением уступчивых мест груди. Состояние расценивается как тяжелое. Синдром аспирации мекония диагностируется на основании внешних признаков дыхательной недостаточности, физикального осмотра и рентгенографической картины. Лечение комплексное, направлено на механическое очищение бронхиального дерева, усиленную оксигенацию и борьбу с инфекционными осложнениями.
Общие сведения
Синдром аспирации мекония – поражение легких новорожденного с высокой вероятностью летального исхода. Смертность достигает 10%, связана с массивной аспирацией мекониальных масс и развитием септического состояния. Частицы первородного кала определяются в амниотической жидкости у 5-20% рожениц, однако заболевание возникает не всегда. Синдром аспирации мекония встречается с частотой около 2-4%. Обычно развивается у доношенных и переношенных детей, у недоношенных встречается реже в связи с особенностями нервной системы, практически исключающими пассаж мекония в околоплодные воды. Является одной из важнейших проблем современной педиатрии в связи с многофакторностью развития и трудностями терапии. В частности, нередко необходимо длительное нахождение ребенка на ИВЛ, что может служить дополнительной причиной развития резистентных к лечению пневмоний.
Причины синдрома аспирации мекония
Хотя этиология состояния продолжает изучаться, большинство исследователей склоняются к гипоксической природе синдрома аспирации мекония. Недостаток кислорода, который возник внутриутробно или в процессе родов, рефлекторно повышает тонус парасимпатической нервной системы. Одновременно происходит централизация кровоснабжения, то есть перераспределение крови с преимущественной циркуляцией в жизненно важных органах (сердце, легкие, мозг) в ущерб всем остальным органам и системам, в том числе кишечнику. Эти два фактора в сумме приводят к гипоксии сосудов брыжейки и рефлекторному расслаблению гладкой мускулатуры кишечника. Как следствие, происходит пассаж первородного кала в околоплодные воды с дальнейшим попаданием в легкие.
Существует большое количество возможных причин гипоксии. Чаще всего дефицит поступления кислорода связан с патологией плаценты, поскольку именно плацентарный кровоток является источником кислорода во внутриутробном периоде развития. Как правило, речь идет о хронической фетоплацентарной недостаточности, обусловленной соматическими заболеваниями матери (в частности, сахарным диабетом и артериальной гипертензией), патологией сосудов плаценты и т. д. Второй вариант – это патологии пуповины или механическое сдавление дыхательных путей (обвитие), что также запускает описанные выше механизмы, приводящие к появлению мекония в околоплодных водах. Определенную роль играет большой вес плода и малое количество амниотической жидкости.
Симптомы и диагностика синдрома аспирации мекония
Синдром аспирации мекония может развиваться с первых минут жизни или спустя несколько часов и даже дней после периода мнимого благополучия. Во многом это зависит от того, как долго малыш испытывал гипоксию, находясь в утробе матери. При раннем появлении симптомов ребенок начинает испытывать трудности с дыханием сразу после рождения. Малыш тяжело и шумно дышит, заметно западение надключичных ямок, межреберных промежутков и других уступчивых мест грудной клетки. Внешне ребенок цианотичный, беспокойный, в тяжелых случаях нервная система, наоборот, угнетена, и пациент выглядит заторможенным. При отсроченном начале синдрома аспирации мекония наблюдаются те же симптомы, но время их возникновения приходится на более поздний период.
Первичная диагностика возможна еще в процессе планового обследования во время беременности. Кардиотокография плода отчетливо показывает затруднение дыхания малыша, в подобных случаях необходимо дальнейшее обследование и поиск причин гипоксии, в частности – анализ амниотической жидкости для выявления в ней частиц мекония. Возможно решение вопроса о досрочном родоразрешении. В процессе интранатальной диагностики синдрома аспирации мекония обращает на себя внимание зеленоватый цвет околоплодных вод, иногда частицы мекония удается визуализировать. Также часто наблюдается зеленоватый цвет ногтей, кожи и пуповины малыша, что, как правило, свидетельствует в пользу длительной внутриутробной гипоксии и тяжелого течения синдрома аспирации мекония.
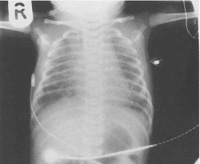
Аускультативно педиатр прослушивает разнокалиберные хрипы, при перкуссии легких участки приглушения чередуются с участками с коробочным звуком. Данные физикального осмотра подтверждаются рентгенографически. На снимке определяются участки ателектаза (спадания альвеол) и эмфиземы (патологического расширения дистальных отделов легких). Такая картина является следствием механической закупорки частицами мекония просвета мелких бронхов, а также вторичного воспалительного процесса, обусловленного токсичностью мекониальных масс. В тяжелых случаях на рентгенограмме обнаруживается так называемая «снежная буря», когда почти вся поверхность альвеол спадается, и остается множество эмфизематозно расширенных участков, неспособных обеспечить циркуляцию воздуха.
Лечение синдрома аспирации мекония
Если синдром аспирации мекония диагностируется еще до родов, то уже в процессе родоразрешения, когда рождается головка, необходимо произвести отсасывание специальным катетером Де Ли. Одна только эта манипуляция, выполненная как можно раньше, позволяет частично освободить верхние дыхательные пути и значительно улучшить оксигенацию. После рождения пациентам с синдромом аспирации мекония проводится лаваж (введение физиологического раствора в трахею с последующим отсасыванием до чистого отделяемого). При наличии выраженной дыхательной недостаточности показано подключение новорожденного к системе ИВЛ.
Важно учитывать, что к моменту подключения ИВЛ легкие должны быть очищены, поскольку в противном случае возможно продвижение оставшихся частиц мекония в дистальные отделы с последующим усугублением дыхательной недостаточности. С целью более быстрого расправления участков ателектаза назначается сурфактант, иногда – оксид азота. Обязательно применение антибиотиков, поскольку частым осложнением синдрома аспирации мекония является аспирационная пневмония. В наиболее тяжелых случаях выполняется экстракорпоральная мембранная оксигенация. Все манипуляции проводятся в отделении реанимации.
Прогноз и профилактика синдрома аспирации мекония
Основным фактором, провоцирующим развитие синдрома аспирации мекония, является внутриутробная гипоксия, поэтому все профилактические мероприятия проводятся в период беременности. Необходима своевременная диагностика и лечение фетоплацентарной недостаточности и соматических заболеваний матери. Стоит избегать перенашивания, которое также повышает риск синдрома аспирации мекония. Прогноз заболевания неблагоприятный. Летальность составляет 10%, выжившие дети в дальнейшем часто имеют хронические легочные патологии. Возможно отставание в развитии вследствие длительной гипоксии.
Синдром аспирации мекония у новорожденных
Общая информация
Краткое описание
Российская ассоциация специалистов перинатальной медицины (РАСПМ)
Год утверждения: 2017 (пересмотр каждые 3 года)
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Эпидемиология
Околоплодные воды могут быть окрашены меконием в 8-20% всех родов [1, 2, 8, 9]. Причем после полных 42 недель частота достигает 23-52% [10, 11]. От 2 до 9% новорожденных, у которых воды были окрашены меконием, в последствие отмечается клиническая картина САМ [2, 12, 13]. Около трети новорожденных с САМ требуют интубации трахеи и механической вентиляции легких [13]. Летальность при САМ в связи с тяжелыми повреждениями паренхимы легких и развитием легочной гипертензии может превышать 20%. Другие осложнения, включая СУВ, встречаются у 10-30% детей с САМ [14].
Диагностика
Диагностика
— курение, наркомания (особенно, кокаин) [2].
Комментарии: Необходимо проводить дифференциальный диагноз с врожденной пневмонией.
Дифференциальный диагноз
— Транзиторным тахипноэ новорождённых и другими состояниями, сопровождающимися развитием дыхательной недостаточности в раннем неонатальном периоде.
Лечение
Рекомендуется дифференцированный подход к оказанию помощи в родильном зале новорожденным с околоплодными водами, содержащими меконий [26]. Акушеры должны заранее предупредить врачей-неонатологов, если околоплодные воды окрашены меконием и имеются признаки дистресса плода. Санация ротоглотки после рождения головки плода не снижает вероятности развития респираторного дистресс-синдрома или клинически выраженного синдрома мекониальной аспирации, включая подгруппы, где имело место наличие густого мекония, отмечались признаки дистресса у плода или родоразрешение выполнялось абдоминальным путем [19].
Комментарии: В случае отсутствия лаважа желудка в родильном зале при наличии мекония в околоплодных водах не зарегистрировано вторичных осложнений, связанных с регургитацией и/или аспирацией мекониального желудочного содержимого [29]. В то же время лаваж желудка рассматривается как потенциально опасная манипуляция, поскольку введение рото- или назогастрального зонда в родильном зале нередко сопровождается развитием апноэ и/или брадикардией [30].
Эмболия околоплодными водами
Общая информация
Краткое описание
Эмболия околоплодными водами (ЭОВ) – критическое состояние, связанное с попаданием амниотической жидкости в легочные сосуды с развитием симптомокомплекса шока смешанного генеза, вплоть до остановки сердечной деятельности, острой дыхательной недостаточности и острого синдрома ДВС. ЭОВ рассматривается как анафилактическая реакция на биологически активные вещества, входящие в состав амниотической жидкости.
Название протокола: Эмболия околоплодными водами
Код протокола:
Код(ы) МКБ-10:
O88 Акушерская эмболия
Включено: легочная эмболия во время беременности, родов или в послеродовом периоде
O88.0 Акушерская воздушная эмболия
O88.1 Эмболия амниотической жидкостью
O88.2 Акушерская эмболия сгустками крови
O88.3 Акушерская пиемическая и септическая эмболия
O88.8 Другая акушерская эмболия
Сокращения, используемые в протоколе:
ЭОВ – эмболия околоплодными водами
ДВС – диссеминированное внутрисосудистое свертывание
КОС – кислотно-основное состояние
ЦВД – центральное венозное давление
Дата разработки протокола: май 2013 года.
Категория пациентов: беременные, роженицы, родильницы.
Пользователи протокола: акушеры-гинекологи. При подозрении на эмболию околоплодными водами необходимо вызвать анестезиолога-реаниматолога.
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Перечень основных диагностических мероприятий:
1. R-графия легких
2. Эритроциты, гемоглобин, гематокрит
3. Тромбоциты
4. Фибриноген
5. Время свертывания
6. Паракоагуляционные тесты
7. ЭКГ
8. КОС и газы крови
9. ЦВД
Диагностические критерии:
Необходимые условия для попадания околоплодных вод в кровоток:
— превышение амниотического давления над венозным;
— зияние сосудов матки.
Факторы, повышающие риск ЭОВ:
— Многорожавшая
— Околоплодные воды, загрязненные меконием
— Разрывы шейки матки
— Внутриутробная гибель плода
— Очень сильные тетанические схватки
— Стремительные или затяжные роды
— Амниоцентез
— Приращение плаценты
— Преждевременная отслойка нормально расположенной плаценты
— Многоводие
— Разрыв матки
— Хориоамнионит
— Макросомия
— Плод мужского пола
— Операция кесарева сечения
Причины амниотической эмболии при кесаревом сечении:
— избыточное давление на матку извне;
— попытки извлечь плод через разрез несоответствующий размерам головки плода;
— выраженная гиповолемия.
Возможные пути проникновения околоплодных вод в кровоток матери:
1. Трансплацентарный путь (через дефект плаценты).
2. Через сосуды шейки матки.
3. Через межворсинчатое пространство – при преждевременной отслойке нормально расположенной плаценты.
4. Через сосуды любого участка матки – при кесаревом сечении, нарушении, нарушении целостности плодных оболочек, разрывах матки.
Клиника ЭОВ представлена двумя основными синдромами:
— кардиопульмональным шоком
— и коагулопатией (синдромом ДВС).
Клиническая картина амниотической эмболии во время родов и после родов:
внезапное начало
— бледность кожных покровов
— беспокойство и страх, иногда боли в грудной клетке
— нарушение дыхания
— возникает потрясающий озноб
— гипертермия до 39 градусов и более
— нарастает цианоз кожи лица и конечностей
— резко затруднено дыхание, может развиться возбуждение с тонико – клоническими судорогами, и затем, почти сразу, может наступить кома.
— после вышеуказанной клинической симптоматики, возможно, ожидать профузное кровотечение из половых путей.
Клинические проявления амниотической эмболии при кесаревом сечении в условиях общей анестезии:
— внезапное трудно объяснимое снижение насыщения крови кислородом (SpO2) до 85%, а в тяжелых случаях до 70%, во время или сразу после извлечения плода;
— при ИВЛ повышение давления в дыхательном контуре до 35 – 40 и более см вод.ст.;
— при аускультации возможны хрипы в легких;
— развивается развернутый ДВС синдром.
Клинические проявления амниотической эмболии при кесаревом сечении в условиях регионарной анестезии:
— внезапное возбуждение пациентки во время или сразу после извлечения плода;
— снижение насыщения крови кислородом (SpO2) до 85%, а в тяжелых случаях до 70%, во время или сразу после извлечения плода;
— затрудненное дыхание;
— при аускультации возможны хрипы в легких;
— развивается развернутый ДВС синдром.
Дифференциальный диагноз
| Симптомы | Эмболия околоплодными водами | Тромбоэмболия легочной артерии |
| Тахикардия |
Повышение давления в дыхательных путях
Увеличения ЦВД
Кратковременно
Лечение
Цели лечения: оказание экстренной помощи.
Своевременно проведенные мероприятия первой очереди купируют анафилактическую реакцию и предотвращают развитие коагулопатического осложнения.
Акушерская тактика при купировании признаков ЭОВ и стабилизации состояния беременной – роды вести через естественные родовые пути под непрерывным мониторным наблюдением за состоянием роженицы и плода.
Акушерская тактика при коагулопатическом осложнении эмболии околоплодными водами заключается в немедленном оперативном родоразрешении и тщательном хирургическом гемостазе, не исключается расширение операции и перевязка подвздошных артерий.
На следующие сутки после родоразрешения – 30 мг преднизолона 4 раза в сутки в/в. В последующие сутки 30 мг преднизолона в/в однократно.
Анестезиологическая тактика при коагулопатическом осложнении:
— анестезия только общая;
— массивная инфузионная, трансфузионная терапия;
— медикаментозная коррекция коагулопатических расстройств;
— антибактериальная терапия;
— кардиальная терапия;
— продленная ИВЛ;
— контроль диуреза;
— контроль ЦВД;
— профилактика полиорганной недостаточности.
Индикаторы эффективности лечения: не допустить материнской смертности.
Что такое аспирация околоплодными водами

Поиск
Эмболия околоплодными водами или анафилактоидный синдром беременности
В лекции представлены современные представления об эмболии околоплодными водами (анафилактоидный синдром беременности)- механизмы развития данного состояния, критерии диагностики, клинические, гемодинамические и гематологические проявления, принципы терапии.
Amniotic fluid embolism or anaphylactoid syndrome of pregnancy
The lecture presents the modern conception of amniotic fluid embolism (anaphylactoid syndrome of pregnancy) — the mechanisms of development of this condition, the diagnostic criteria, clinical, hemodynamic and hematological manifestations, treatment principles.
Анафилактоидный синдром беременности
Поскольку симптоматика эмболии околоплодными водами (ЭОВ) сходна с клинической картиной анафилактического шока, а, точнее, при ЭОВ имеют место анафилактически-подобные, или анафилактоидные симптомы шока, современные ученые предполагают, что наиболее точным определением ЭОВ является анафилактоидный синдром беременности. Во многих странах термин «ЭОВ» уже не используется.
Clarc et al. описал гемодинамические нарушения при ЭОВ и впервые предположил, что более подходящим для данного состояния будет название анафилактоидный синдром беременности. Инициальное событие — выброс вазоактивных субстанций в материнский кровоток, что приводит к спазму легочных сосудов. Глубокая гипоксемия, тяжелая степень легочной гипертензии и правожелудочковая недостаточность характеризуют первую фазу. Именно в эту начальную фазу в первые часы уровень материнской смертности составляет около 50%. Вторая фаза манифестирует левожелудочковой недостаточностью, гемодинамически характеризуется повышением давления в легочной артерии, давления в концевых легочных капиллярах, центрального венозного давления с развитием отека легких. В 1988 году было основано национальное общество по регистрации случаев ЭОВ и сформулированы критерии диагностики ЭОВ, основанные на анамнезе и клинической картине (Clark, Hankins et Dudley). Критерии диагностики ЭОВ, разработанные национальным общество по регистрации случаев ЭОВ:
— острая гипотензия или внезапная остановка сердца;
— острая гипоксия или диспноэ, цианоз, или остановка дыхания;
— коагулопатия, лабораторно подтвержденное внутрисосудистое свертывание, фибринолиз или тяжелое кровотечение;
— развитие вышеуказанных состояний во время родов, кесарева сечения или в течение 30 минут после родов;
— отсутствие каких-либо других причин, которые могли бы способствовать развитию вышеуказанных состояний.
Итак, при исследовании ЭОВ было отмечено значительное сходство клинических, гемодинамических и гематологических проявлений ЭОВ с аналогичными проявлениями при септическом и анафилактическом шоке. (Clark, 1995). Очевидно, что клиническая картина при этих заболеваниях не идентична; лихорадка является характерной для септического шока, кожные проявления более часто встречаются при анафилактическом. Тем не менее значительное количество схожих моментов, характерных для этих состояний, позволяют предположить аналогичные патофизиологические механизмы их возникновения и развития.
При септическом, как и при анафилактическом шоке имеет место поступление инородных веществ (бактериальные эндотоксины, специфические антигены) в циркулирующую кровь, что приводит к высвобождению различных эндогенных медиаторов. Точные патофизиологические механизмы анафилактоидного синдрома беременности до конца не изучены. Когда амниотическая жидкость поступает в материнский кровоток, происходит высвобождение эндогенных медиаторов (простагландинов, лейкотриенов, гистамина, брадикинина, цитокинов, тромбоксана, факторов, активирующих тромбоциты). Реакция материнского организма на высвобождение медиаторов заключается в гипоксии, гемодинамических нарушениях, коагулопатии потребления.
Схожие патофизиологические механизмы также лежат в основе жировой эмболии у небеременных женщин. Именно высвобождение эндогенных медиаторов приводит к принципиальным физиологическим изменениям, характеризующим данные синдромы. Эти изменения включают нарушение кровоснабжение миокарда, уменьшение сердечного выброса, легочную гипертензию, синдром диссеминированного внутрисосудистого свертывания (ДВС), описанный при анафилактическом и септическом шоке многими авторами (Parker, 1980; Smith, 1980; Kapin и Ferguson, 1985; Lee, 1988; Parillo, 1993).
Последовательность процессов развития гемодинамических нарушений, наблюдаемых при ЭОВ в экспериментальных условиях, аналогична процессам, происходящим при анафилаксии у животных (Kapin и Ferguson, 1985). Анафилактоидная реакция также описана у людей, при этом имеет место неиммунологическое высвобождение аналогичных медиаторов (Parker, 1980). Интересен и тот факт, что у 41% пациенток с ЭОВ имела место лекарственная аллергия или атопия в анамнезе (Clark, 1995).
Способность метаболитов арахидоновой кислоты вызывать аналогичные физиологические и гемодинамические изменения описана у пациенток с ЭОВ (Clark, 1985). В 1986 году в эксперименте на животных Azegami и Mori показали, что применение ингибиторов лейкотриенов предотвращает животных с ЭОВ от развития летальных осложнений.
Среди факторов, являющихся возможными предикторами анафилактоидного синдрома беременности, были изучены следующие: размер плода, использование окситоцина, возраст беременной, несколько родов в анамнезе, отслойка плаценты, разрыв матки, внутриутробная гибель плода и другие.
Clark et al. создали национальный регистр пациенток с эмболией оклоплодными водами. Изучив истории беременностей, осложнившихся анафилактоидным синдромом, ученые обнаружили взаимосвязь между возникновением данного синдрома и плодом мужского пола. В аналогичном исследовании было выявлено, что 41% пациенток с ЭОВ имеют отягощенный аллергоанамнез и предрасположенность к атопии. Clark et al. также обнаружили, что у 46 исследованных пациенток клинические, гемодинамические проявления, гематологические и лабораторные данные сходны с клинической картиной, развивающейся у пациентов с септическим и анафилактическим шоком. Теория Clark et al. была подтверждена и в других исследованиях (Courtney, Fraser)
В прошлом основным гистологическим подтверждением синдрома ЭОВ было обнаружение клеточных элементов плода в легочной артерии. Несколько исследований, проведенных в течение последних десятилетий, однако свидетельствуют о том, что эти гистологические находки не являются специфичными (так, сквамозные клетки обнаруживаются в легочных сосудах беременных женщин с митральным стенозом ревматической этиологии (Plaush, 1983; Covon, 1984; Clark, 1986). Клеточные элементы плода обнаруживаются в 50% случаев и у беременных в отсутствии ЭОВ (Clark, 1995). Таким образом, говоря об ЭОВ, следует иметь в виду, что в патологический процесс вовлекаются не только легочные сосуды.
Итак, термин «ЭОВ» представляется на современном уровне не совсем верным. Многие современные авторы полагают, что термин «ЭОВ», описывающий синдром, включающий острую гипоксию, гемодинамический коллапс и коагулопатию, должен быть заменен более точным — анафилактоидный синдром беременности.
Определение, этиология, патогенез
1. Анафилактоидный синдром беременности является одной из наиболее опасных причин шока и выраженных нарушений гемостаза в акушерской практике. Классически синдром характеризуется гипоксией, гипотензией и коагулопатией.
2. Частота АСБ колеблется, по разным данным, от 1:8 000-20 000 до 1: 80 000 родов.
3. Высокая смертность при АСБ обусловлена трудностью ранней диагностики, стремительным развитием заболевания и неэффективностью лечения в поздние сроки.
4. Первостепенное значение имеют профилактика данного состояния, настороженность медицинского персонала к группе высокого риска по развитию данной патологии с целью выявления ранних признаков попадания амниотической жидкости в кровяное русло.
АСБ можно рассматривать в трех клинических аспектах:
1. АСБ как самостоятельное заболевание, которому не предшествует никакая акушерская патология, за исключением раннего или преждевременного отхождения ОПВ и бурной родовой деятельности.
2. АСБ на фоне акушерской патологии, которая сама по себе может привести к смерти, либо, не являясь смертельной в совокупности с эмболией приводит к летальному исходу
— АСБ на фоне заболеваний, протекающих с развитием синдрома ДВС;
— АСБ на фоне генетических тромбофилий;
— АСБ на фоне антифосфолипидного синдрома (АФС)
3. Несмертельный АСБ, который обусловлен попаданием незначительного количества околоплодных вод в маточный кровоток; в данном случае АСБ характеризуется типичной клинической картиной, но переносится организмом матери без лечения или при применении комплекса терапевтических мероприятий.
— АСБ при отсутствии фоновых заболеваний
-АСБ на фоне осложненного течения беременности (ДВС, генетические тромбофилии, АФС)
5. Предрасполагающими факторами АСБ являются:
— низкое венозное давление у роженицы при гипотонии;
— бурная, дискоординированная родовая деятельность;
— необоснованная стимуляция сократительной активности матки;
— особенно опасно быстрое, неравномерное внутривенное введение окситоцина в целях родовспоможения, введение окситоцина с неравномерным интервалом или резкая его отмена;
— переношенная, многоплодная беременность;
— роды крупным или мертвым плодом;
— прерывание беременности на поздних сроках методом вливания растворов (физиологический раствор, глюкоза) за оболочки;
— введение растворов в межворсинчатое пространство (это приводит к отслойке плаценты и создает благоприятные условия для эмболии и для нарушений коагуляции крови).
Факторы риска возникновения АСБ
Беременные старше 30 лет
Интенсивные сокращения матки (физиологические или медикаментозно-индуцированные)
Разрыв шейки матки
Преждевременная отслойка плаценты
Внутриутробная гибель плода
Преждевременная отслойка плаценты
80% случаев развивается во время родов
20% случаев развивается до или после родов
6. Состав околоплодных вод:
— электролиты в диссоциированном состоянии,
— белок в количестве от 210 до 390 мг%,
— мукопротеиды с высоким содержанием углеводов;
— большое количество липидов;
— гормоны, разнообразные ферменты и другие биологически активные вещества;
— гистамин, уровень которого значительно повышается при поздних гестозах.
— простагландины класса Е. Далее повышается уровень простагландинов класса F при прогрессирующем снижении PgE.
Основной этиологический фактор развития АСБ — поступление амниотической жидкости в системный материнский кровоток с дальнейшей эмболизацией сосудов легких амниотической жидкостью, локальной активацией прокоагулянтного звена в сосудах легких, а затем и системной активацией, что приводит к молниеносному развитию циркуляторного коллапса и ДВС. АСБ часто заканчивается летально как для матери, так и для плода (50% плодов умирает, или у них развивается асфиксия или дистресс-синдром).
Механизм попадания околоплодных вод (ОПВ) в кровоток матери обусловлен двумя факторами:
а) разрывом оболочек и проникновением вод в межворсинчатое пространство или иной участок венозной системы матки;
б) давлением внутриамниотической жидкости, которое превышает давление в венозной системе матери.
ОПВ могут попадать в кровоток матери следующими путями:
а) через дефекты плаценты (трансплацентарный путь);
б) через сосуды шейки матки при разрывах шейки матки (трансцервикальный путь).
ЭОВ может возникнуть и при преждевременной отслойке нормально расположенной плаценты (ПОНРП). При этом разрыв оболочек должен произойти выше области внутреннего маточного зева. Если оболочки разрываются непосредственно в области внутреннего маточного зева при невставившейся головке плода, то давление околоплодных вод очень быстро падает, что практически исключает попадание ОПВ в межворсинчатое пространство.
Амниотическая жидкость содержит клеточный материал, включая сыровидную смазку, сквамозные эпителиальные клетки. Содержание липидов, клеток, прокоагулянтная активность и вязкость амниотической жидкости повышаются с увеличением срока беременности и достигают максимума во время родов. Механизмы поступления амниотической жидкости в материнский кровоток до конца не изучены, однако входными воротами могут быть повреждения плацентарных мембран либо дефекты мембран плода, если они находятся вблизи материнских венозных сосудов. Места поступления амниотической жидкости — в местах прикрепления плаценты или нижний сегмент матки и шейка. Возможно, что цервикальные вены, расширяющиеся во время родов, способствуют поступлению амниотической жидкости после разрывов мембран, когда головка плода находится в канале шейки матки, таким образом, блокируя дренаж и создавая повышенное ретроградное гидростатическое давление. Это приводит к поступлению амниотической жидкости в вены цервикального канала и, соответственно, в системную циркуляцию. Амниотическая жидкость также может поступать в материнскую циркуляцию при повреждении миометрия или через места абнормального прикрепления плаценты, а также при преждевременной отслойке нормально расположенной плаценты. Если в амниотической жидкости содержится меконий, эмболия сопровождается более выраженным ДВС-синдромом по сравнению с ОПВ, не содержащими меконий. При морфологическом исследовании сквамозные клетки плода определяются в микрососудах легких. В настоящее время специфическим патологическим маркером ЭОВ могут служить моноклональные антитела ТНК-2. Диагностическую ценность также представляют моноклональные антитела (CD 61-GPIIIa, Beta-HCG F VIII-vWhPL-антитела), позволяющие определить мегакариоциты плода и клетки синцитиотрофобласта в материнских микрососудах легких.
При поступлении в системный кровоток матери амниотическая жидкость мгновенно активирует прокоагулянтную систему, приводя к ДВС и вызывая микроэмболизацию пульмональных сосудов не только вследствие активации коагуляционного каскада, но и из-за отложения в сосудах гипервискозной амниотической жидкости и ее составляющих. Как уже было отмечено, этот процесс более распространен при контаминации меконием.
Пульмонарная патофизиология ЭОВ
Тяжесть легочных проявлений зависит от состава, количества и вязкости амниотической жидкости, попадающей в материнские сосуды легких. Чем больше клеточных элементов (сыровидная смазка, сквамозные эпителиальные клетки плода) содержится в амниотической жидкости, тем более вязкой она является. Амниотическая жидкость и ее составляющие вызывают механическую обструкцию мелких и крупных сосудов легких. Это приводит к нарушению перфузии и диффузионной способности легких, а также к вазоконстрикции, которая в свою очередь сопровождается правожелудочковой недостаточностью, формированием легочного сердца, повышением давления в легочной артерии с последующим уменьшением наполнения левого желудочка, снижением сердечного выброса. Следствием этого является тканевая гипоксия, ишемия, метаболический ацидоз и кардиогенный шок.
Система гемостаза при ЭОВ
Амниотическая жидкость содержит вещества с высокой тромбопластиноподобной активностью, которая увеличивается со сроком гестации. Кроме того, амниотическая жидкость обладает антифибринолитической активностью, которая также увеличивается со сроком гестации. Неспецифическое ингибирование фибринолитической системы может спровоцировать развитие ДВС и диффузных тромбозов. Сквамозные клетки плода в амниотической жидкости высвобождают эндотелин-1, вазо- и бронхоконстриктор, что еще более усугубляет гемодинамические нарушения.
Прокоагулянтная активность амниотической жидкости коррелирует с лецитин/сфингомиелиновым отношением в течение беременности. Амниотическая жидкость in vitro ускоряет протромбиновое время, АЧТВ, а также свертывающие способности фактор VII-обедненной плазмы. Таким образом, амниотическая жидкость действует не только как «общий тромбопластин», но и как заменитель активации тканевой фазы. Механизмы, посредством которых амниотическая жидкость активирует прокоагулянтную систему, включают в себя непосредственную активацию фактора X в присутствии молекул кальция, в фактор Ха. Фактор Ха — одна из наиболее тромбогенных субстанций. Фактор Ха в присутствии фактора V и фосфолипидов (включая амниотическую жидкость и поверхности тромбоцитов) немедленно конвертирует протромбин в тромбин. Как только образовался тромбин, фибриноген конвертируется в фибрин. Таким образом, у пациентов с ЭОВ формируются микротромбы, состоящие из тромбоцитов и фибрина, проходящие через системную и пульмонарную циркуляцию. Это внутрисосудистое свертывание сопровождается тромбозами микроциркуляторного русла, тромбоэмболиями и кровотечением.
У пациенток с фоновыми гемодинамическими нарушениями при АСБ может остро развиться вторичная коагулопатия. Амниотическая жидкость при исследовании in vitro проявляет свойством укорачивать время свертывания, обладая тромбопластиноподобным эффектом, а также индуцирует агрегацию тромбоцитов, способствует высвобождению фактора III (Ratnoff и Vosbugh, 1952, Beller,1963); содержит фактор, напрямую активирующий X фактор (Courtney и Davison, 1972). Однако в исследовании Philips и Davidson было показано, что количества прокоагулянтов в чистой амниотической жидкости недостаточно для того, чтобы вызвать значительное внутрисосудистое свертывание. Таким образом, результаты разных исследований во многом оказывались противоречивыми.
Природа коагулопатии, ассоциированной с отслойкой плаценты и АСБ, во многом сходна, и в ее основе лежит попадание в материнский кровоток клеточных элементов плода, обладающих тромбопластиноподобными эффектами (Clark, 1995).
Диагноз АСБ следует заподозрить в первую очередь при внезапном развитии острой дыхательной недостаточности (ОДН) во время нормальных родов. ОДН возникает вследствие окклюзии легочных сосудов амниотической жидкостью, усиленной вазоконстрикции сосудов легких, и впоследствии окклюзии сосудов тромбами. Это приводит к кардиогенному шоку, системному кардиоваскулярному и легочному коллапсу. Клинические симптомы острой легочной недостаточности — внезапный приступ тахипное, диспное и периферический цианоз из-за нарушения перфузии. Эти признаки часто сопровождаются развитием острого легочного сердца с правосердечной недостаточностью, гипоксией, ишемией, метаболическим ацидозом. Газовый состав артериальной крови характеризуется снижением значений РО2 и РСО2. Также имеет место повышение центрального венозного давления.
Клиника обычно развивается во время родов. Вслед за развитием ОДН, кардиогенного шока и коллапса часто возникает массивное маточное кровотечение вслед за системными геморрагическими проявлениями различной локализации. При развитии ДВС источник кровотечения определить и предугадать достаточно сложно. Однако наиболее часто геморрагические проявления характерны для мест венепункции, также имеют место гематурия, гемофтиз и иногда внутричерепное кровоизлияние. Кроме того, следует обращать внимание на кожные покровы и слизистые оболочки (петехии, пурпура). При прогрессировании ДВС возникает окклюзия микроциркуляторного русла почек, печени, ЦНС и других органов и систем. В дальнейшем это приводит к нарушению перфузии органов и развитию полиорганной недостаточности. Наиболее достоверными лабораторными показателями, необходимым для оценки ДВС, являются на уровни АТ III, фибринопептида А, Д-димера, фрагментов протромбиина и уровень тромбоцитов.
Диагностика анафилактоидного синдрома беременности основывается на следующих клинических данных: острая гипоксия, острая гипотензия, внезапная остановка сердца и/или коагулопатия, которая не является следствием какой-либо другой причины. Точный диагноз АСБ может быть поставлен на основании анализа совокупности клинических данных, дополнительных лабораторных данных и патологоанатомических исследований. АСБ — диагноз исключения.
Дифференциальный диагноз следует проводить со следующими заболеваниями:
— тромбоэмболия легочной артерии;
— эклампсия; — преждевременная отслойка нормально расположенной плаценты
— шок вследствие кровотечения;
— инфаркт миокарда; — септический шок;
— лекарственная идиосинкразия; — цереброваскулярные нарушения;
— жировая и воздушная эмболия;
— анафлаксия на применение местных анестетиков;
Дифференциальная диагностика состояний, остро возникающих до, во время и после родов (Donaldson J.O.)