что такое арены в химии
Арены. Свойства аренов.
Арены (ароматические углеводороды) – соединения, в молекулах которых содержится одно или несколько бензольных колей – циклических групп атомов углерода со специфическим характером связей.
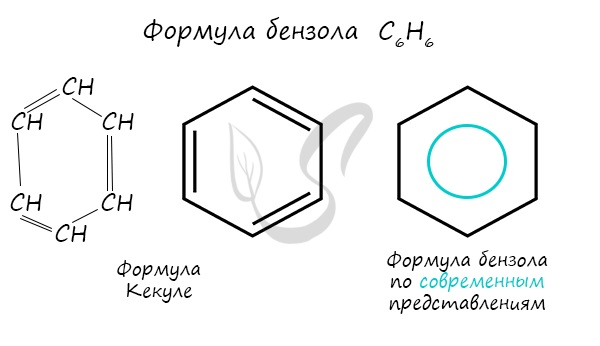
Бензол – молекулярная формула С6Н6. Впервые была предложена А. Кекуле:
Строение аренов.
Все связи равноценны. Энергия сопряжения – количество энергии, которую надо затратить, чтобы разрушить ароматическую систему.
Именно это обуславливает специфические свойства бензола – проявление ароматичности. Это явление было открыто Хюккелем, и называется правилом Хюккеля.
Изомерия аренов.
Арены можно разделить на 2 группы:
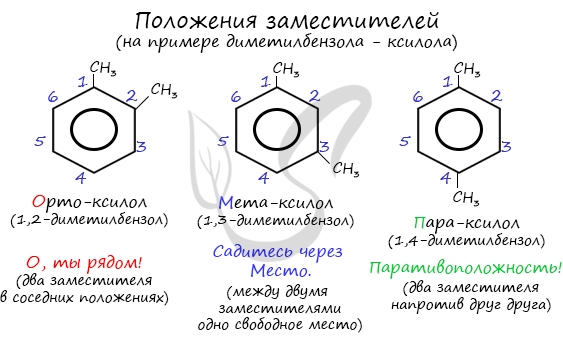
Для аренов характерна структурная изомерия, которая объясняется взаимным расположением заместителей в кольце. Если в кольце находится 2 заместителя, то они могут находиться в 3-х различных положениях – орто (о-), мета (м-), пара (п-):
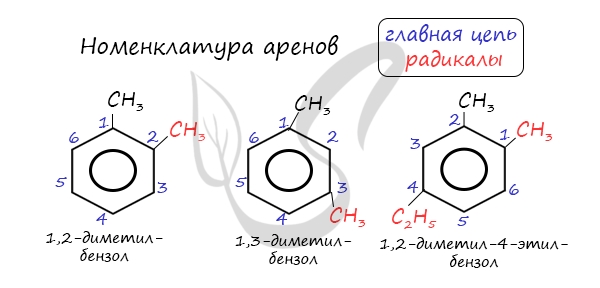
Называют арены словом «бензол» с указанием заместителей в кольце и их положения:
Физические свойства аренов.
Первые члены ряда – жидкости без цвета с характерным запахом. Они хорошо растворяются в органических растворителях, но нерастворимы в воде. Бензол токсичен, но имеет приятный запах. Вызывает головную боль и головокружения, при вдыхании больших количеств паров можно потерять сознание. Раздражает слизистую оболочку и глаза.
Получение аренов.
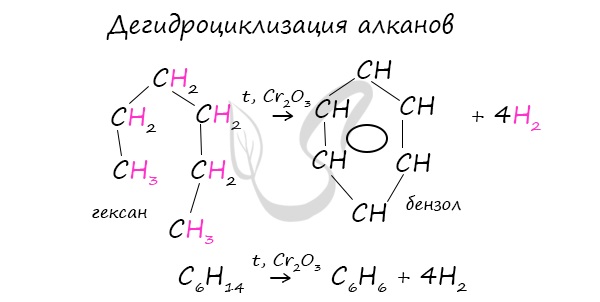
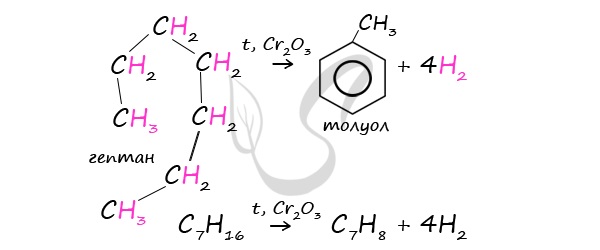
1. Из алифатических углеводородов с помощью «ароматизации» предельных углеводородов, входящих в состав нефти. При пропускании над платиной или оксидом хрома наблюдается дигидроциклизация:
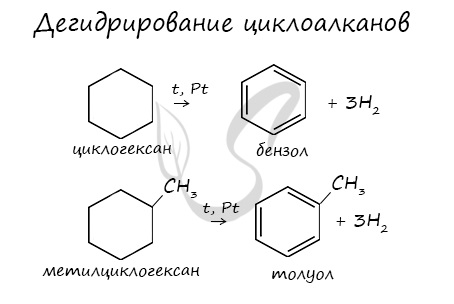
2. Дегидрирование циклоалканов:
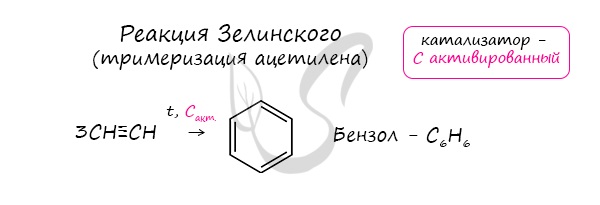
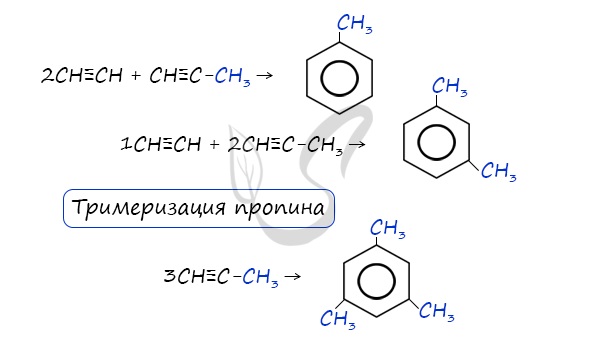
3. Из ацетилена (тримеризация) при пропускании над раскаленным углем при 600°С:
4. Реакция Фриделя – Крафтса в присутствии хлорида алюминия:
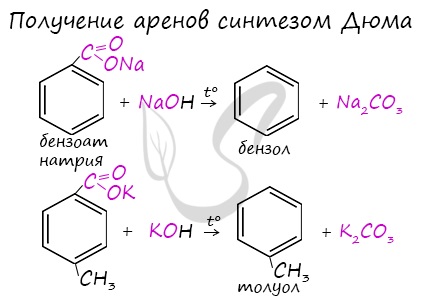
5. Сплавление солей ароматических кислот с щелочью:
Химические свойства аренов.
Реакции замещения аренов.
Ядро аренов обладает подвижной π-системой, на которую действуют электрофильные реагенты. Для аренов характерно электрофильное замещение, которое можно представить так:
Электрофильная частица притягивается к π-системе кольца, затем образуется прочная связь между реагентом Х и одним из атомов углерода, при этом единство кольца нарушается. Для восстановления ароматичности выбрасывается протон, а 2 электрона С-Н переходят в π-систему кольца.
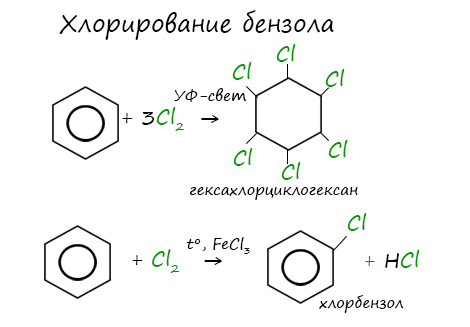
1. Галогенирование происходит в присутствии катализаторов – безводных хлоридов и бромидов алюминия, железа:
2. Нитрование аренов. Бензол очень медленно реагирует с концентрированной азотной кислотой при сильном нагревании. Но если добавить серную кислоту, то реакция протекает очень легко:
4. Алкилирование алкенами. В результате происходит удлинение цепи, реакция протекает в присутствии катализатора – хлорида алюминия:
Реакции присоединения аренов.
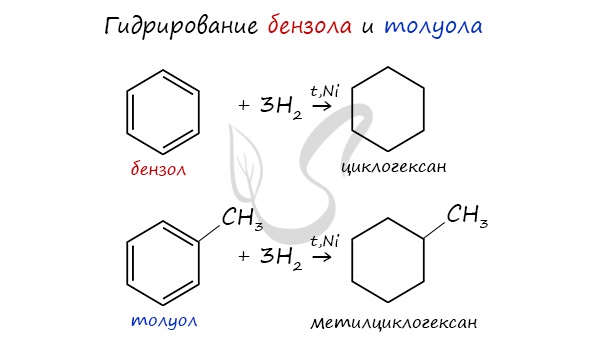
1. Гидрирование (при катализаторах) аренов:
2. Радикальное галогенирование при взаимодействии паров бензола и сильного УФ-излучения. В результате образуется твердый продукт – С6H6Cl6:
3. Окисление кислородом воздуха. Реакция протекает при оксиде ванадия (V) и 400°С:
Гомологи бензола имеют ряд отличий – на их продукты я изначальный заместитель в кольце:
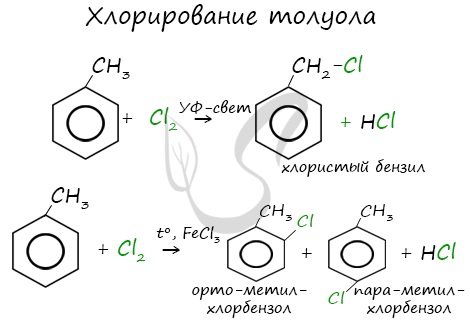
Замещение в кольце возможно только в присутствие катализатора (хлорида железа и алюминия), замещение протекает в орто- и пара- положения по отношению к алкильному радикалу:
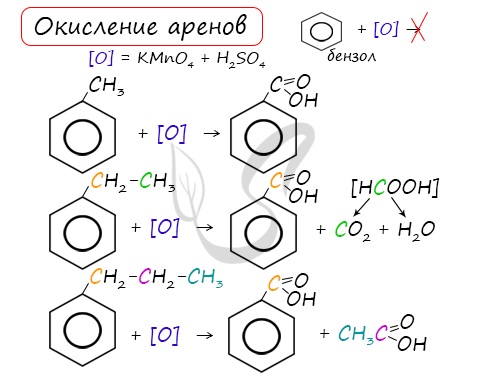
Если действуют сильные окислители (перманганат калия), то цепь алкильная разрушается и образуется бензойная кислота:
Бензол и его гомологи
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
Номенклатура и изомерия аренов
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 😉
Получение аренов
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
При дегидроциклизации гептана получается толуол.
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
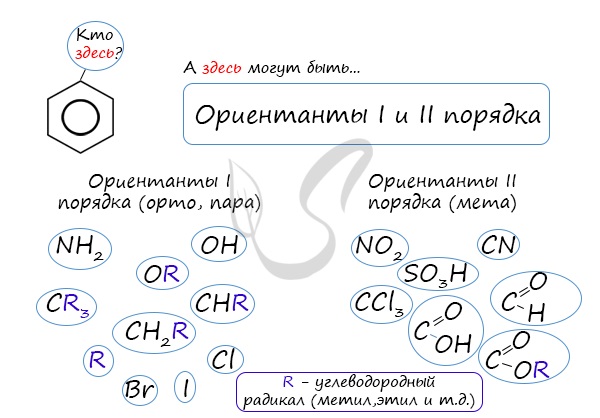
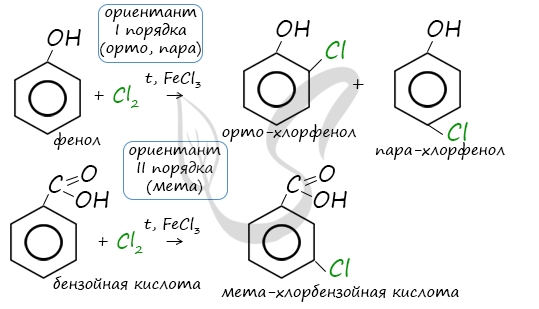
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
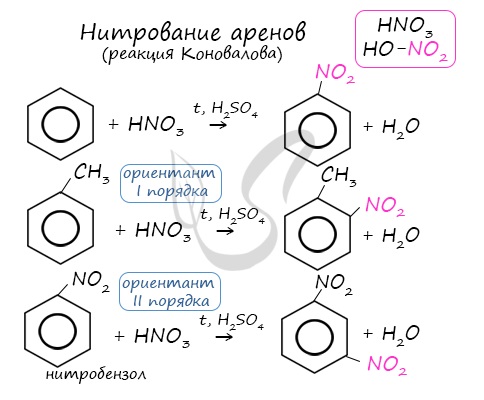
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
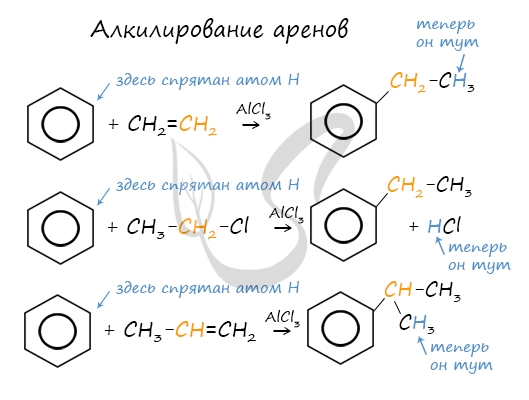
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
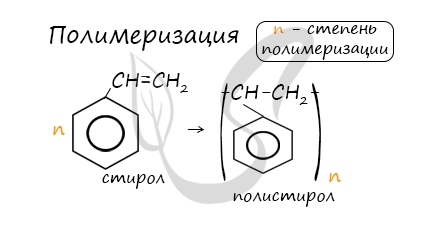
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Арены — номенклатура, получение, химические свойства
Ароматические углеводороды – соединения углерода и водорода, в молекуле которых имеется бензольное кольцо. Важнейшими представителями ароматических углеводородов являются бензол и его гомологи – продукты замещения одного или более атомов водорода в молекуле бензола на углеводородные остатки.
Строение молекулы бензола
Первое ароматическое соединение – бензол – было открыто в 1825 г. М. Фарадеем. Была установлена его молекулярная формула – С6Н6. Если сравнить его состав с составом предельного углеводорода, содержащего такое же количество атомов углерода, — гексаном (С6Н14), то можно заметить, что бензол содержит на восемь атомов водорода меньше. Как известно, к уменьшению количества атомов водорода в молекуле углеводорода приводит появление кратных связей и циклов. В 1865 г. Ф. Кекуле предложил его структурную формулу как циклогексантриена – 1, 3, 5.

Таким образом, молекула, соответствующая формуле Кекуле, содержит двойные связи, следовательно, бензол должен иметь ненасыщенный характер, т. е. легко вступать в реакции присоединения: гидрирования, бромирования, гидратации и т. д.
Однако данные многочисленных экспериментов показали, что бензол вступает в реакции присоединения только в жестких условиях (при высоких температурах и освещении), устойчив к окислению. Наиболее характерными для него являются реакции замещения, следовательно, бензол по характеру ближе к придельным углеводородам.
Пытаясь объяснить эти несоответствия, многие ученые предлагали различные варианты структуры бензол. Окончательно строение молекулы бензола было подтверждено реакцией его образования из ацетилена. В действительности углерод — углеродные связи в бензоле равноценны, и их свойства не похожи на свойства ни одинарных, ни двойных связей.
В настоящее время бензол обозначают или формулой Кекуле, или шестиугольником, в котором изображают окружность.
Данные измерения длин связей подтверждают эти предположения. Выяснено, что все С—С связи в бензоле имеют одинаковую длину (0,139 нм). Они несколько короче одинарных С—С связей (0,154 нм) и длиннее двойных (0,132 нм).
Существуют также соединения, молекулы которых содержат несколько циклических структур.
Изомерия и номенклатура
Для гомологов бензола характерна изомерия положения нескольких заместителей. Простейший гомолог бензола — толуол (метилбензол) — не имеет таких изомеров; следующий гомолог представлен в виде четырех изомеров:

Основой названия ароматического углеводорода с небольшими заместителями является слово бензол. Атомы в ароматическом кольце нумеруют, начиная от старшего заместителя к младшему:

По старой номенклатуре положения 2 и 6 называют ортоположениями, 4 — пара-, а 3 и 5 — метаположениями.
Физические свойства
Бензол и его простейшие гомологи в обычных условиях весьма токсичные жидкости с характерным неприятным запахом. Они плохо растворяются в воде, но хорошо — в органических растворителях.
Химические свойства бензола
Реакции замещения. Ароматические углеводороды вступают в реакции замещения.
1. Бромирование. При реакции с бромом в присутствии катализатора, бромида железа (ΙΙΙ), один из атомов водорода в бензольном кольце может замещаться на атом брома:
2. Нитрирование бензола и его гомологов. При взаимодействии ароматического углеводорода с азотной кислотой в присутствии серной (смесь серной и азотной кислот называют нитрующей смесью) происходит замещение атома водорода на нитрогруппу —NO2:
Восстановлением образовавшегося в этой реакции нитробензола получают анилин — вещество, которое применяется для получения анилиновых красителей:
Эта реакция носит имя русского химика Зинина.
Реакции присоединения. Ароматические соединения могут вступать и в реакции присоединения к бензольному кольцу. При этом образуются циклогексан или его производные.
1. Гидрирование. Каталитическое гидрирование бензола протекает при более высокой температуре, чем гидрирование алкенов:
2. Хлорирование. Реакция идет при освещении ультрафиолетовым светом и является свободнорадикальной:
Гомологи бензола
Состав их молекул отвечает формуле СnH2n-6. Ближайшие гомологи бензола:
Все следующие за толуолом гомологи бензола имеют изомеры. Изомерия может быть связана как с числом и строением заместителя (1, 2), так и с положением заместителя в бензольном кольце (2, 3, 4). Соединения общей формулы С8Н10:
По старой номенклатуре, употребляемой для указания относительного расположения двух одинаковых или разных заместителей в бензольном кольце, используют приставки орто— (сокращенно о-) – заместители расположены у соседних атомов углерода, мета- (м-) – через один атом углерода и пара— (п-) – заместители друг против друга.
Первые члены гомологического ряда бензола – жидкости со специфическим запахом. Они легче воды. Являются хорошими растворителями.
Гомологи бензола вступают в реакции замещения (бромирование, нитрирование). Толуол окисляется перманганатом при нагревании:
Гомологи бензола используются как растворители, для получения красителей, средств для защиты растений, пластмасс, лекарств.
Химия. 10 класс
Конспект урока
Урок № 4. Арены (ароматические углеводороды)
Перечень вопросов, рассматриваемых в теме: урок посвящён ароматическим углеводородам, их номенклатуре, физическим и химическим свойствам, а также роли в жизни человека.
Ароматический углеводород – соединение, содержащее в молекуле специфическую систему чередующихся одинарных и двойных связей (сопряженных π-связей).
Акцептор – атом или группа атомов, принимающих электроны и образующих химическую связь за счёт своей пустой орбитали и неподелённой пары электронов донора.
Гибридизация – процесс взаимодействия разных, но близких по энергии электронных орбиталей, приводящий к их выравниванию по форме и энергии.
Гомология – явление сходства по составу, строению, химическим свойствам и принадлежности к тому же классу одного вещества с другим веществом, но различающиеся друг от друга на одну или несколько групп СН2. Группу СН2 называют гомологической разностью.
Горение – быстро протекающий процесс окисления вещества, сопровождающийся большим выделением тепла и ярким свечением.
Группа функциональная – группа атомов, определяющая наиболее характерные химические свойства вещества и его принадлежность к определенному классу.
Донорное (электронодонорное) свойство – способность атомов элемента отдавать свои электроны другим атомам. Количественной мерой донорных свойств атомов, образующих химическую связь, является их электроотрицательность.
Изомерия – явление существования веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
Формула структурная – изображение молекулы, в котором показан порядок связывания атомов между собой. Химические связи в таких формулах обозначаются черточками.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Арены (ароматические углеводороды) – органические соединения, имеющие общую формулу СnH2n –6, а в составе молекулы бензольное кольцо (ядро).
Бензольное кольцо – это цикличная группа шести атомов углерода; структуру в виде кольца предложил Ф. А. Кекуле в 1865 г.
Простейшим представителем аренов является бензол С6Н6. Среди других представителей можно отметить, например, кумол (изопропилбензол) C6H5CH(CH3)2.
Полная структурная (формула, предложенная Ф.А. Кекуле)
Сокращенная структурная (формула, предложенная Ф.А. Кекуле)
Сокращенная структурная с сопряженными связями
sp 2 гибридизация – это смешивание одного s и двух p электронных облаков и образование трёх одинаковых (гибридных). Гибридные облака участвуют в образовании 3 δ-связей, лежащих на плоскости. Оставшееся у каждого из шести атомов углерода негибридизованное третье p-облако имеет форму гантели. Шесть p-облаков, перекрываясь с соседними над и под плоскостью δ-связей, участвует в образовании общего 6-электронного облака, которое является общим для всех атомов углерода.
Свойства бензола и других ароматических соединений и их обусловленность электронным строением молекулы бензола.
Физические и химические свойства бензола и его гомологов
Физические свойства бензола
Бензол является хорошим растворителем. В пробирку нальем 1 мл дистиллированной воды и добавим несколько капель масла. Масло не растворяется в воде даже после перемешивания содержимого. Во вторую пробирку нальем 1 мл бензола. Перемешаем содержимое. Масло растворяется в бензоле. Однако ввиду высокой токсичности, использование бензола в качестве растворителя нежелательно.
Сопряжение π-связей в молекуле бензола
Образование пи-связей в молекуле бензола обусловлено тем, что негрибридизованные облака образуют общие электронные плотности в виде колец над и под плоскостью молекулы бензола. Обратите внимание, что в результате образуется общее пи-электронное облако, а все связи между атомами углерода в молекуле бензола оказываются одинаковыми (их еще называют полуторными). Именно пи-электронные облака являются объяснением того факта, что – в отличие от первоначального варианта представления молекулярной формулы бензола с чередованием одинарных и двойных связей – бензол не проявляет выраженных свойств алкенов.
Химические свойства бензола
Реакции замещения (как алканы)
Реакция происходит в присутствии катализатора (соли FeBr3, AlCl3, AlBr3):
Реакции присоединения (как алкены)
Взаимодействие с перманганатом калия
Не обесцвечивает раствор перманганата калия (реакция не идёт)
Бензол горит жёлтым коптящим пламенем, если внести в пламя стекло, на нем быстро оседает слой копоти.
Электрофильное замещение в ароматических соединениях можно представить реакцией присоединения-отщепления. Эта реакция проходит в несколько стадий.
Сравнение свойств бензола и толуола
Отношение к раствору KMnO4
Горение на воздухе
Присоединение хлора (галогена)
Замещение водорода хлором (галогеном)
Отношение к раствору KMnO4
Окисление боковых цепей (в присутствии H2SO4 или KMnO4)
Горение на воздухе
Присоединение хлора (галогена)
Замещение водорода хлором (галогеном)
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Определение формулы бензола. Пошаговый тренажер решения задач
Найдите молекулярную формулу бензола, если известно, что его пары в 2,78 раз тяжелее азота.
1. Вывод формулы для нахождения относительной массы бензола из формулы относительной плотности.
D (по N2) = Mr (бензола) / Mr (N2), выведем формулу для расчета относительной массы бензола:
2. Рассчитаем относительную молекулярную массу азота, используя периодическую систему химических элементов Д.И. Менделеева.
3. Рассчитаем относительную молекулярную массу бензола (с точностью до целых):
Mr (бензола) = 2,78 · 28 = 77,84 ≈ 78.
Ответ: Mr (бензола) = 78
4. Бензол является углеводородом. Все углеводороды состоят из углерода и водорода.
5. Нахождение количества атомов углерода в молекуле бензола. Количество атомов углерода в молекуле бензола равно […].
Пусть количество атомов углерода равно x, а количество атомов водорода – y. Поскольку вещество имеет равное количество атомов углерода и водорода, то x = y.
Составим уравнение с учетом значений относительной атомной массы углерода и водорода, а также вычисленной относительной молекулярной массы бензола.
Следовательно, в молекуле содержатся шесть атомов углерода и шесть атомов водорода.
6. Составление молекулярной формулы бензола С6Н6
2. Решение задачи о свойствах толуола
В результате взаимодействия 2,5 моль толуола с бромом образовалось 700 г трибромтолуола. Найдите практический выход реакции (%) от теоретически возможного. Ответ округлите до целого числа.