что такое аневризма межпредсердной перегородки у новорожденного
Аневризма межпредсердной перегородки
1. Общие сведения
Аневризма (изредка употребляется менее корректный термин «аневризм») – локальное выбухание, выпячивание какой-либо граничной поверхности в виде растянутого мешка, либо веретенообразное расширение стенок кровеносного сосуда (мешотчатые аневризмы также встречаются на сосудах, однако значительно реже). Таким образом, аневризма межпредсердной перегородки (МПП) – это искривление мембраны, отделяющей правое предсердие от левого. В норме эта перегородка герметична, сравнительно пряма и не выгибается, – по крайней мере, существенно, – ни в одну из сторон.
Аневризма МПП многими авторами квалифицируется как патология лишь в том случае, если выпячивание в какую-либо сторону (в правое предсердие, в левое или S-образно) превышает 10 мм и сочетается с пролапсом (провисанием) митрального клапана. В пересчете к общей популяции такая аномалия встречается редко, чаще она сопутствует врожденным заболеваниям соединительной ткани. Аневризму МПП называют «малой сердечной аномалией» или «малым пороком сердца», поскольку в большинстве бессимптомных случаев она не представляет реальной опасности и не нуждается в лечении, да и обнаруживается, как правило, случайно. Однако из этого отнюдь не следует, что о данной аномалии можно забыть, не придавая ей никакого значения: ситуация может резко усугубиться с началом увеличения аневризмы, истончения МПП и ее спонтанного прорыва, после чего динамика становится уже непредсказуемой.
2. Причины
Т.н. овальное окно в МПП после рождения должно зарастать, но в некоторых случаях перегородка остается очень тонкой и в дальнейшем под давлением крови выпячивается. Основными факторами риска, как указано выше, являются генетически обусловленные аномалии продукции и развития соединительной ткани, а также ВУИ – внутриутробные инфекции плода.
3. Симптомы и диагностика
В раннем детском возрасте течение, как правило, бессимптомное. Однако поводом для тщательного обследования, – в т.ч. кардиологического, где обычно и выявляется аневризма, – должны стать отставание ребенка в психофизическом развитии, недостаточная масса тела, частые ОРВИ; на более поздних этапах – признаки инфантильности репродуктивной системы, постоянная бледность, утомляемость от малейших физических нагрузок, боли в области сердца, иногда заметное выпячивание грудной клетки в кардиальной зоне.
Выраженность указанного симптомокомплекса широко варьирует – от тяжелой до незначительной, существенно не влияющей на качество жизни и общее развитие. Наибольшую опасность представляет разрыв аневризмы с формированием межпредсердного дефекта (сообщения), вследствие чего нарушается нормальная, естественная для миокарда гемодинамика. Однако и такое развитие событий выше не случайно названо непредсказуемым: в одних случаях приобретенный порок позволяет в течение десятилетий вести вполне обычный образ жизни, в других создает угрозу инсульта или т.н. внезапной сердечной смерти. После 40 лет пациента с дефектом МПП, образовавшимся вследствие прорыва аневризмы, зачастую приходится инвалидизировать из-за нарастающих гемодинамических нарушений и рисков.
В диагностике, помимо анамнеза, результатов клинического осмотра и наблюдения, наибольшее значение приобретает ультразвуковая эхокардиография (ЭхоКГ), которая практически не имеет противопоказаний, допускает повторные исследования в динамике и позволяет наглядно визуализировать аневризму с точной оценкой ее характеристик. В качестве уточняющей диагностики, – обычно для выявления и исследования сопутствующих аномалий и пороков, – дополнительно могут быть назначены чреспищеводное УЗИ, КТ, катетеризация сердца.
4. Лечение
При неосложненной аневризме нет необходимости ни в консервативном, ни в кардиохирургическом лечении (по очевидным причинам любое хирургическое вмешательство на сердце само по себе рискованно и применяется только как крайняя, не имеющая альтернатив мера). Однако наблюдение и регулярные контрольные обследования у кардиолога являются строго обязательными: состояние и размеры аневризмы необходимо отслеживать. В случаях угрожающего развития клинической ситуации больной немедленно госпитализируется, и в кардиохирургическом стационаре производится ушивание дефекта или пластика МПП с использованием биоинертных материалов.
Аневризма межпредсердной перегородки
Нарушение анатомического строения сердца (пороки сердца) всегда негативно сказывается на жизни человека. К таким нарушениям относится и аневризма межпредсердной перегородки (АМПП). Она встречается как у взрослых, так и у маленьких детей и представляет собой деформацию перегородки между предсердиями. В совокупности с другими патологиями сердца, может привести к летальному исходу. Рассказываем, как АМПП лечат, и как избежать осложнений.
Особенности заболевания
Аневризма – выпячивание или расширение стенки артерии, в некоторых случаях вены. Это происходит из-за истончения гладкой мускулатуры в стенках сосудов. В результате происходит увеличение площади поверхности сосуда, что ведет к нарушению кровообращения. Это явление может быть как врожденным, так и приобретенным.
Аневризмы могут быть истинными или ложными. Стенками истинной аневризмы всегда является стенка сосуда, пусть и измененная. Ложные аневризмы образуются чаще всего в результате повреждения артериального сосуда, когда стенками аневризмы становятся прилежащие мягкие ткани. Как и все аневризмы сердца, АМПП относится к истинным.
Межпредсердная перегородка – это внутренняя стенка сердца, разделяющая левое и правое предсердия, камеры, в которых начинаются малый и большой круг кровообращения.
Аневризма межпредсердной перегородки – это первичная аномалия развития межпредсердной перегородки (МПП). Патология представляет собой выпячивание части МПП в левое или правое предсердие из-за повышенной эластичности тканей. Растяжение вызывает давление крови во время сердечных сокращений.
Это заболевание относится к малым порокам сердца и редко несет серьезную опасность для жизни и здоровья. Но оно способно усилить негативное воздействие других сердечных патологий.
При выпячивании аневризмы более чем на 10 мм. в любое из предсердий, существует риск нарушения динамики крови. В этом случае к АМПП относятся как к более серьезной патологии.
О распространенности АМПП говорить сложно. Исследования, по данному вопросу, имели различные выборки пациентов и разные методы диагностики. Поэтому предполагаемый диапазон частоты встречаемости заболевания широк. По разным данным АМПП наблюдается у 1-5% населения, а иногда исследователи говорят о более чем 10%.
Формы АМПП
У АМПП широкая классификация, которая строится как на анатомических особенностях заболевания, так и на причинах и особенностях его возникновения.
Первоначальная анатомическая классификации выделяла три типа АМПП:
Современная классификация выделяет 5 форм, которые позволяют более точно анализировать особенности гемодинамики:
Классификация АМПП по характеру возникновения:
Классификация АМПП по степени вовлеченности межпредсердной перегородки:
Помимо первичной аневризмы, возникшей из-за анатомических нарушений в тканях, выделяют вторичную АМПП. Она может возникнуть даже на здоровой перегородке в результате слишком сильного кровяного давления в сердце, вызванного другими патологиями. В этом случае лечение направлено на борьбу с заболеванием, ставшим причиной аневризмы.
Причины АМПП
Риск возникновения АМПП берет свое начало во время эмбриогенеза человека. Дело в том, что подавляющее большинство АМПП развивается на месте овального открытого окна (ОО). ОО – отверстие соединяющее левое и правое предсердие, когда ребенок находится в утробе матери.
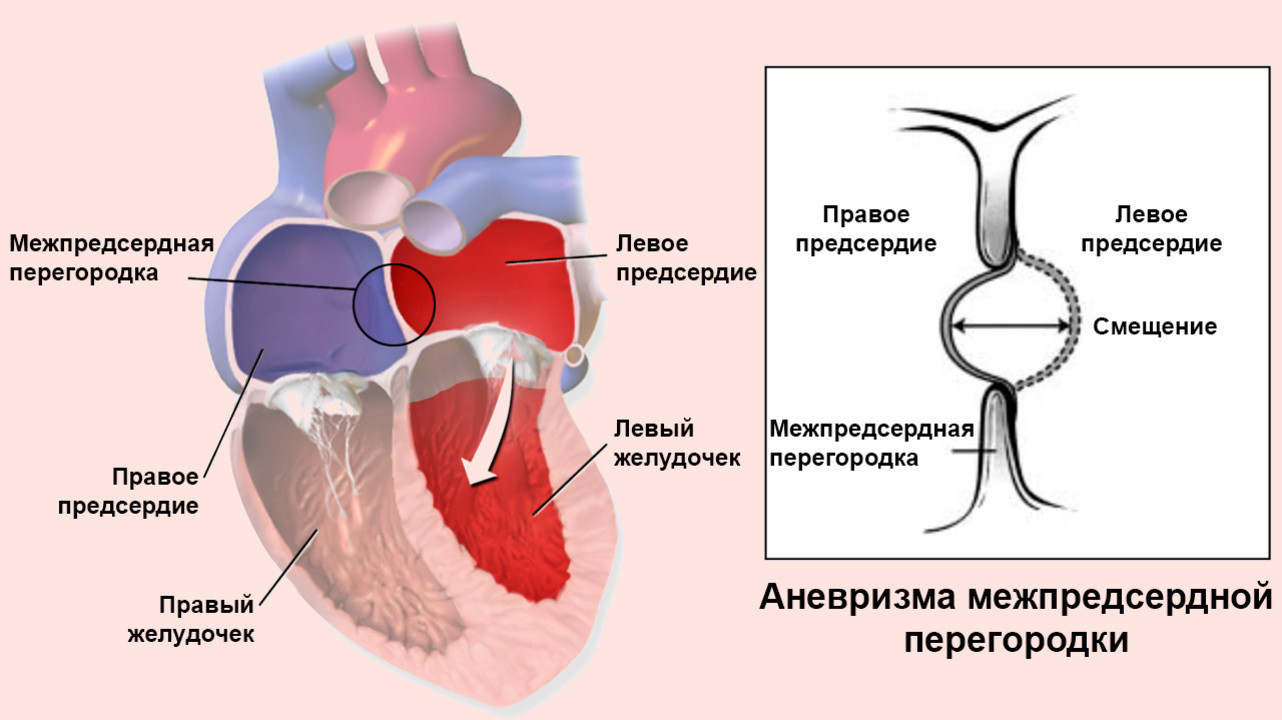
У ребенка в утробе нет возможности дышать легкими. Поэтому часть крови следует из правого предсердия к легким, чтобы обеспечить их питание и развитие. А остальная часть крови сбрасывается через ОО в левое предсердие и направляется на большой круг кровообращения, для питания всего организма.
После рождения, когда ребенок делает свой первый вдох, и начинает функционировать малый круг кровообращения, необходимость в ОО отпадает. При нормальных условиях оно зарастает в течении нескольких дней. Заросший участок является слабой точкой в перегородке и подвержен максимальным деформациям.
Важно! Закрытие отверстия в течении нескольких месяцев не считается патологией.
Здоровая МПП способна выдерживать давление крови без изменения формы. Однако существует ряд факторов, нарушающих нормальное анатомическое строение перегородки и провоцирующих выпячивание.
Для детей характерна только врожденная АМПП. Главной ее причиной, в большинстве случаев, является образ жизни матери во время беременности и состояние ее здоровья. К факторам, которые вызывают АМПП у младенцев относят:
У взрослых АМПП возникает из-за сердечных патологий, которые ослабляют ткани перегородки.
Приобретенная АМПП классифицируется по скорости развития заболевания:
Эта классификация необходима для составления плана лечения и прогнозирования заболевания.
Симптомы АМПП
При небольшх выпячиваниях МПП заболевание может проходить бессимптомно, и о наличии патологии может сказать только инструментальная диагностика. Однако у детей подросткового возраста и беременных женщин могут наблюдаться некоторые неспецифические симптомы:
Важно! Высокие физические нагрузки также могут провоцировать проявление симптомов. Они характерны для широкого спектра заболеваний, а характер проявления индивидуален для каждого человека. Поэтому их анализ редко помогает в диагностике конкретного заболевания.
При сочетании АМПП с другими пороками сердца на первый план выходит предрасположенность к легочным инфекциям и хроническому бронхиту.
Существует риск разрыва аневризмы из-за сильного кровяного давления. Симптомы развиваются крайне быстро и представлены:
АМПП при беременности
При наличии у беременной женщины небольшой АМПП не существует каких либо серьезных рисков и противопоказаний. Опасность несут только аневризмы с выпячиванием более 10 мм. В таком случае весь процесс беременности должен проходить под наблюдением специалиста, так как кардинальные изменения в гемодинамике могут стать поводом к отказу от естественных родов и применению кесарева сечения.
Беременность может быть категорически противопоказана, когда аневризма осложнена другими пороками сердца. До 70% АМПП имеют одно или несколько небольших отверстий, которые могут не соответствовать эмбриональному развитию ОО. В таком случае АМПП рассматривают в сочетании с малым дефектом МПП (отверстие в МПП).
При небольших размерах дефекта межпредсердной перегородки (ДМПП) беременность и роды не противопоказаны, но при этом требуется постоянное наблюдение врача.
Однако если размер дефекта МПП достигает определенного значения, могут наблюдаться следующие явления:
В таком случае, на ранних сроках беременности (до 12 недель) производится искусственный аборт, в более поздние сроки – кесарево сечение.
Диагностика заболевания
Широкий спектр неспецифических симптомов и частая бессимптомная картина заболевания требуют точной диагностики. К ним относятся:
Они позволяют выяснить местоположение и размер аневризмы, а также наличие сопутствующих заболеваний.
При изучении работы сердца, в первую очередь применяется электрокардиография. Метод основан на регистрации электрических импульсов, которые с пределенной частотой иннервирую мускулатуру сердца, заставляея все его камеры сокращаться в определенном порядке. Это простой безболезненный метод дающий общие представления о работе сердца человека.
При изучении динамики крови применяются методы допплерографии или компьютерной томографии. Благодаря им удается исследовать все особенности, нарушения и аномалии кровообращения, их локализацию и размеры.
Но наиболее эффективным и информативным методом, при диагностике АМПП, является чреспищеводное эхокардиографическое исследование (ЧП-ЭхоКГ). Метод основан на обычном ультразвуковом исследовании, во время которого пациенту через пищевод вводят ультразвуковой датчик. Это позволяет получать наиболее точные данные о работе сердца так как отсутствуют помехи в виде ребер, подкожного жира и слоев мягких тканей.
Для предотвращения рвотного рефлекса применяется местная анестезия глотки и языка. При введении датчика на глубину около 10 см, пациенту необходимо его проглотить. Процедура проводится на голодный желудок и длится 5-15 минут.
Для ЧП-ЭхоКГ существует протокол, по которому необходимо изучать следующие параметры:
Противопоказания для ЧП-ЭхоКГ:
Заболевания пищевода (варикозное расширение вен, воспалительные процессы, кровотечения);
Лечение
При размерах аневризмы менее 10 мм в лечении нет необходимости. Пациенту рекомендуют профилактические мероприятия, правильная диета и регулярные осмотры у кардиолога.
При аневризмах больших размеров или при наличии в МПП отверстия, для пациента разрабатывается курс комплексных мероприятий, которые включают в себя как консервативное, так и хирургическое лечение.
Консервативное лечение
Применяется при аневризме, размер которой может повлиять на гемодинамику крови, но хирургическое вмешательство несет больше рисков, чем потенциальной пользы.
В первую очередь оно направлено на:
Все лекарственные препараты назначаются исключительно лечащим врачом. В их число входят:
К консервативному лечению относят и составление правильной диеты.
Хирургическое лечение
Хирургическое вмешательство показано в следующих случаях:
Операция проходит в 3 этапа:
Послеоперационный период пациент проводит в отделении интенсивной терапии с проведением искусственной вентиляцией легких до тех пор, пока пациент не вернется в стабильное состояние. Время в стационаре зависит от скорости восстановления пациента и может достигать нескольких месяцев.
Возможные осложнения
При наличии аневризмы возможны следующие осложнения:
Прогноз и профилактика
Не существует какого либо целенаправленного метода профилактики АМПП. Есть только общие рекомендации, снижающие риски ее возникновения:
Заключение
Аневризма межпредсердной перегородки может быть опасным заболеванием, нуждающимся в серьезном лечении. Однако в большинстве случаев эта патология требует только здоровой диеты и умеренной физической активности и регулярного наблюдения у своего лечащего врача.
Что такое аневризма межпредсердной перегородки у новорожденного
АМПП — аневризма межпредсердной перегородки
ДИ — доверительный интервал
ЛП — левое предсердие
МПП — межпредсердная перегородка
ООО — открытое овальное окно
ПП — правое предсердие
ТТ ЭхоКГ — трансторакальная эхокардиография
ЧП ЭхоКГ — чреспищеводная эхокардиография
Аневризма межпредсердной перегородки (АМПП) — первичная аномалия развития межпредсердной перегородки (МПП) с вовлечением в аневризматическое выпячивание части или всей МПП вследствие избытка ткани. Наиболее часто АМПП формируется в «слабых» местах МПП — в области овального окна или в проекции спонтанного закрытия дефекта МПП [1, 2]. В качестве фактора, провоцирующего формирование АМПП, рассматривается разница в межпредсердном давлении. Вторичная АММП этиологически обусловлена заболеваниями, вызывающими повышение давления в правом предсердии (ПП) или левом предсердии (ЛП).
В антенатальном периоде МПП формируется по мере развития плода из 3 разных структур: 1) первичной перегородки (septum primum), локализующейся в нижней части предсердия и формирующей клапан для отверстия в области овальной ямки; 2) вторичной перегородки (septum secundum), располагающейся в верхней части предсердия; 3) остатков правого рога венозного синуса (зона от верхней до нижней полой вены). Гистологическое строение МПП неоднородно: в верхней части она представлена преимущественно миокардом, который ближе к краю овального окна сменяется фиброзной тканью [3]. Нижний край и клапан овального окна представлены тонкой тканью с отдельными волокнами кардиомиоцитов, слоями коллагена и эластических волокон. В отсутствие патологии соединительной ткани такое строение позволяет МПП сохранять контрактильность и способность сопротивляться растяжению [4, 5].
Сведения о распространенности АМПП значительно варьируют в зависимости от группы выборки и метода обследования. В общей популяции при аутопсии АМПП встречается в 1% случаев, возрастая при скрининговой трансторакальной (ТТ ЭхоКГ) и чреспищеводной (ЧП ЭхоКГ) эхокардиографии до 4,9% и даже 10% [6—8].
Один из дискутабельных вопросов, влияющих на мнение о распространенности и клиническом значении АМПП, — в каком качестве рассматривать варианты АМПП с одним или несколькими небольшими дефектами, которые не соответствуют принципам эмбрионального развития овального окна и сопровождаются шунтированием крови [9]. Частота выявления таких вариантов достигает 70% всех случаев АМПП. С анатомических позиций определение АМПП и дефекта МПП диаметрально противоположные. АМПП ассоциирована с избытком ткани, а дефект — с недостатком. Наиболее адаптированным представляется мнение, согласно которому к истинной АМПП следует относить только те случаи, которые не сопровождаются фенестрацией. Остальные варианты рассматривают как сочетание АМПП с малыми дефектами МПП, так как в этой ситуации клиническое значение АМПП, как и при изолированном дефекте МПП, функционирующем овальном окне, определяется не только ее размерами, но и объемом сброса через фенестрации, а также гемодинамическими нарушениями, которые вызывают этот сброс.
Существенный вклад в разброс данных о распространенности АМПП внесла эволюция взглядов на количественные критерии межпредсердной аневризмы, представления о которых формировались на протяжении десятилетий. Отсутствие единого подхода привело к широкой вариабельности мнений с уменьшением специфичности диагностики АМПП при использовании более «мягких» количественных критериев, характеризующих экскурсию аневризмы и величину ее основания.
До последнего времени наиболее часто применялись предложенные M. Silver и J. Dorsey (1978 г.) [1] критерии, которые долгое время считались «золотым стандартом» диагностики АМПП — максимальная экскурсия аневризматического выпячивания в ПП или ЛП, или суммарная экскурсия — более 10 мм, длина основания — более 15 мм [10—13]. На рисунке представлена схема измерения количественных характеристик АМПП при ЭхоКГ.

В последующих работах основные параметры АМПП варьировали как в сторону увеличения, так и уменьшения [13—16]. В одном из последних проспективных исследований [17], в котором использовались приведенные выше критерии, экскурсия АМПП варьировала от 10 до 40 мм (среднее значение 14 мм), основания — от 15 до 30 мм (среднее 20 мм). АМПП диагностирована у 370 (2,42%) из 15 232 обследованных.
В рекомендациях 2015 г. по эхокардиографической диагностике дефекта МПП и открытого овального окна (ООО) [18] диаметр основания аневризмы не упоминается в качестве критерия. Диагностировать АМПП предложено при максимальной экскурсии части или всей МПП в сторону ЛП или ПП более 10 мм или суммарно (общий размер экскурсии в ПП и ЛП) более 15 мм. В случаях с меньшей экскурсии применяют термин «мобильная МПП» [19].
Направление и глубина движения аневризмы в периоды кардиоцикла легли в основу классификации АМПП. Первые классификации включали 3 типа межпредсердных аневризм [20]. В 1989 г. R. Roudant и соавт. [21] определили первый тип аневризмы при локализации аневризматического выпячивания только в области овальной ямки, второй — в области овальной ямки с вовлечением задней части МПП, третий — с вовлечением всей МПП. Первый и второй типы ассоциированы с выбуханием аневризмы только в ПП, третий — только в ЛП. В 1991 г. А. Pearson и соавт. [10] описали дополнительный тип — 1С. В четырех случаях ТТ ЭхоКГ наблюдали преимущественное движение АМПП в ПП, но с экскурсией в ЛП в период ранней систолы или при выполнении пробы Вальсальвы. В классификации, которую широко используют в настоящее время, выделено 5 типов АМПП (табл. 1) [22].

В зависимости от частичного или полного вовлечения в аневризматическое выпячивание МПП предлагают также выделять локальный и генерализованный типы АМПП соответственно [17].
Визуализация АМПП хорошо обеспечивается при выполнении стандартной ЭхоКГ. Эхокардиографические сечения для визуализации АМПП при ТТ ЭхоКГ аналогичны тем, которые используют для оценки МПП: левая парастернальная позиция по короткой оси, апикальная и субкостальная четырехкамерные позиции. ЧП ЭхоКГ обладает большей чувствительностью в распознавании АМПП, а также позволяет выявить состояния, которые часто сочетаются с АМПП и не всегда хорошо визуализируются при ТТ ЭхоКГ (ООО, вторичный дефект МПП). Вместе с тем при ЧП ЭхоКГ увеличивается риск получения ложноположительных результатов диагностики АМПП, как при ТТ ЭхоКГ — ложноотрицательных.
В стандартный протокол эхокардиографического исследования целесообразно включать параметры, указанные в табл. 2.

АМПП может выступать в качестве изолированной внутрипредсердной аномалии и в сочетании с другими структурными аномалиями сердца. Наиболее часто АМПП встречается с внутри- и межпредсердными морфологическими аномалиями — ООО, сеть Киари, удлиненный евстахиев клапан [23—25]. При использовании только ТТ-ЭхоКГ частота выявления сочетания АМПП и ООО снижается ввиду гиподиагностики ООО при ТТ ЭхоКГ без выполнения ЧП ЭхоКГ [26].
В литературе имеются многочисленные данные о взаимосвязи АМПП и ПМК [27—31]. Однако во Фрамингемском исследовании при использовании современных критериев ПМК эта взаимосвязь не подтверждена [32]. Тем не менее для определенных подгрупп, в частности молодых пациентов, перенесших инсульт при нормальных коронарных артериях, указанная зависимость оказалась значимой [16]. В исследовании РЕПЛИКА, в котором группу обследования также составили лица молодого возраста, получены аналогичные результаты для сочетания аневризматичной или мобильной МПП с ПМК, базальными и/или множественными ложными хордами [26].
Значение фенестрации АМПП обсуждено выше. Следует еще раз подчеркнуть, что при малых шунтирующих сбросах только ЧП ЭхоКГ с контрастированием и пробой Вальсальвы является достаточно информативной.
В большинстве случаев клинически АМПП протекает благоприятно, без гемодинамических изменений и клинической манифестации. При аускультации АМПП может быть предположена по наличию щелчков вдоль левого края грудины, аналогичных таковым при пролапсе митрального клапана. Имеются данные о связи АМПП с предсердными нарушениями ритма, изменениями зубца Р на ЭКГ [15]. Блокада правой ножки пучка Гиса встречается в 21,9% случаев [33]. У детей с АМПП имеется предрасположенность к развитию наджелудочковых аритмий, синдрома слабости синусного узла [2].
Активно исследуется роль АМПП в развитии криптогенного инсульта [12, 34]. Связь АМПП с первичными криптогенными инсультами продемонстрировал метаанализ исследований J. Overell и соавт. [35]. Доказано существенное повышение риска развития инсультов при наличии АМПП и ООО. Причем соотношение рисков в подгрупповом анализе для лиц моложе 55 лет даже больше при изолированной АМПП — 6,14 (при 95% доверительном интервале — ДИ от 2,47 до 15,22), чем при изолированном ООО — 3,1 (при 95% ДИ от 2,29 до 4,21), увеличиваясь при сочетании АМПП и ООО до 15,59 (при 95% ДИ от 2,83 до 85,87).
По данным исследования European/PFO-ASA, включившем 581 пациента, перенесшего криптогенный инсульт, вероятность повторного инсульта при ООО составила 2,3%, при сочетании АМПП и ООО — 15,2%, несмотря на прием 300 мг аспирина [36]. В целом АМПП наряду с мобильной МПП и размерами ООО явились, по данным многофакторного анализа J. Lee и соавт. [37], независимыми предикторами повторного инсульта при ООО.
Взаимосвязь АМПП с ООО и риском развития инсульта может быть обусловлена несколькими факторами. Прежде всего при значительных размерах аневризмы и избыточных ее амплитудных характеристиках создаются предпосылки для тромбоэмболических осложнений [16]. Наличие патологически подвижной МПП также является существенным фактором риска развития ООО и парадоксальной эмболии [33]. В частности, подвижная аневризма МПП может способствовать более широкому открытию ООО и тем самым парадоксальной эмболии. Кроме того, мобильная АМПП может вести к ухудшению систолической функции ЛП и к обусловленному этим замедлению кровотока спонтанным контрастированием, что повышает риск тромбообразования в ЛП [38]. Однако чаще мобильная МПП не имеет самостоятельного значения и описывается как ассоциированное состояние при прогрессивном повышении давления в полости ЛП или ПП, при наличии сброса через нее, предсердных аритмиях.
В целом АМПП, как и ООО, может быть отнесена к факторам низкого, а при определенных условиях, к средней степени риска развития мозгового инсульта/кардиоэмболии головного мозга [39].
Связь АМПП с мигренью рассматривается только в контексте ее ассоциированности с функционирующим ООО в силу патогенетических особенностей возникновения мигрени с аурой при праволевом шунтировании (потенциальной возможностью попадания вазоактивных субстанций через межпредсердную коммуникацию в мозговой кровоток) [40].
Медикаментозная (атиагрегантная) терапия пациентам с изолированной АМПП без наличия ООО не показана. При транскатетерном закрытии ООО, сочетающегося с АМПП, отмечено значительное снижение амплитуды ее колебаний и снижение вероятности повторных эмболических эпизодов [41]. Вместе с тем АМПП ассоциирована с большей частотой резидуальных шунтов после чрескожного закрытия ООО, даже при использовании окклюдеров максимального диаметра [42].
Заключение
Аневризма МПП является первичной аномалией развития МПП, а при наличии фенестраций может рассматриваться как вариант межпредсердных коммуникаций наряду с ООО и ДМПП.
Инструментальная диагностика АМПП должна включать стандартную ТТ ЭхоКГ, дополненную при необходимости ЧП-ЭхоКГ. В диагностике и при определении типа аневризмы следует придерживаться современных рекомендаций, что позволит унифицировать результаты научных исследований в этой области.
Выявление АМПП подразумевает обязательный поиск прочих внутрипредсердных структурных аномалий с учетом данных о существенном повышении риска развития инсульта при сочетание АМПП с ООО. У пациентов, перенесших криптогенный инсульт, требуется целенаправленный поиск АМПП, особенно при развитии инсульта в молодом возрасте.
Последующие научные изыскания должны быть направлены на дальнейшее уточнение стратификации риска при АМПП и при ее сочетании с прочими вариантами внутрисердечных структурных аномалий, целесообразности первичной и вторичной профилактики кардиоэмболического инсульта.
Авторы заявляют об отсутствии конфликта интересов.