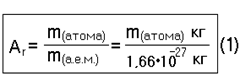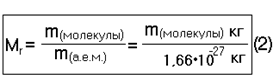что такое абсолютная масса атома
Абсолютная и относительная масса атомов и молекул
Масса атомов и молекул, выраженная в граммах или килограммах (г, кг), называется абсолютной (обозначается m).
Абсолютная масса атомной единицы массы:
Значение Аr приведены в таблице химических элементов Д.И.Менделеева.
Относительной молекулярной массой (Мr) вещества называется число, показывающее во сколько раз данная молекула тяжелее 1 /12 атома 12 С.
Из формул (1) и (2) следует, что Аr и Mr величины безразмерные.
Из формул (1) и (2) вытекает также связь между абсолютной и относительной массами атома и молекулы:
Масса молекулы равна сумме масс атомов, из которых молекула состоит
При определении Мr ионных соединений (солей, кислот и щелочей) структурной единицей вещества условно считается молекула.
Относительная молекулярная масса кристаллогидрата:
При определении Мr кристаллогидратов структурной единицей вещества условно считается ассоциация, состоящая из одной молекулы соли и n молекул воды, связанных с ней.
Допускается также выражение относительной атомной и молекулярной масс в а.е.м.
Дата добавления: 2016-11-26 ; просмотров: 9447 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Определение абсолютной и относительной массы вещества
Абсолютная и относительная масса атомов и молекул
Массу относят к фундаментальным характеристикам атома. Поскольку ее абсолютное значение очень мало, в химии вводится понятие относительной, т.е. условной, атомной массы.
Ничтожный размер атома не исключает наличия у него атомной массы. Вся масса атома сосредоточена в ядре (протон и нейтрон практически в 2000 раз тяжелее, чем электрон). В результате почти вся масса атома приходится на общую массу нейтронов и протонов. К примеру, атомная масса кислорода равняется 2,667·10-23 г. Это его абсолютная атомная масса. Работать с таким числом неудобно. Поэтому было предложено ввести еще одну величину – относительную атомную массу.
В начале XIX века Дж. Дальтон предложил, вычисляя атомную массу, использовать в качестве эталона массу атома водорода, поскольку он является самым легким элементом. Именно по отношению к нему выражались массы атомов прочих элементов.
Однако с учетом того, что на практике чаще использовались кислородные соединения для вычисления атомных масс многих элементов, в качестве эталона удобнее стало использовать атомную массу кислорода. При этом известно, что соотношение атомных масс кислорода и водорода равно 16:1. Так возникло понятие кислородной единицы – 1/16 части его атомной массы.
Таким образом, относительная атомная масса показывает, во сколько раз масса атома конкретного элемента больше массы атома, который принимается за единицу. Сегодня это 1/12 часть массы атома углерода. Это и есть атомная единица массы, которую иногда обозначают как «дальтон».
Относительная атомная масса – отношение массы атома определенного элемента к 1/12 массы атома изотопа углерода-12. По сути относительная атомная масса является безразмерной величиной (при ее расчете единицы измерения сокращаются), но иногда ее значение выражают в атомных единицах массы (а.е.м.).
Абсолютная масса атома углерода составляет 1,993·10-23 г, согласно Периодической таблице Д.И. Менделеева. Его относительная атомная масса равна 12. Следовательно, 1/12 часть массы атома углерода составляет:
Масса одного кислородного атома приблизительно в 16 раз превышает 1/12-ю массы углеродного атома 12С.
Чтобы вычислить относительную молекулярную массу вещества, нужно сложить суммы относительных атомных масс элементов, входящих в состав молекулы, с учетом индексов, которые показывают количество атомов элемента в молекуле. Абсолютная масса одной молекулы равна относительной, умноженной на одну атомную единицу массы (1 а.е.м.).
Относительная атомная масса химического элемента
Например, определение относительной массы атома водорода выглядит так:
Элемент кислород имеет следующую относительную атомную массу:
Из формул следует, что относительная атомная масса является величиной, равной отношению абсолютной атомной массы к единице массы u (или 1 а.е.м.).
Относительная молекулярная масса вещества
Если молекула состоит из атомов нескольких химических элементов, то ее относительная молекулярная масса равна сумме их относительных атомных масс с учетом индексов в формуле вещества.
Рассмотрим пример. Молекула воды имеет в своем составе два атома водорода и один – кислорода. Чтобы определить относительную молекулярную массу, нужно сложить произведения относительной атомной массы каждого элемента на соответствующее количество атомов:
Знание относительной молекулярной массы веществ в газообразном состоянии помогает в решении задач по сравнению их плотности. Для этого высчитывается относительная плотность газов друг по другу, которая равна соотношению их относительных молекулярных масс:
Поскольку закон Авогадро применим исключительно к газообразным веществам, а ученым-химикам часто необходимо знать, сколько молекул, атомов или ионов заключено в определенных порциях твердых веществ или жидкостей, введено понятие молярной массы. Ее значение численно равно относительной молекулярной массе.
Как вычислить абсолютную массу, формулы, примеры
Найти молекулярную массу серной кислоты, используя таблицу Менделеева.
Известно, что молекулярная масса вещества равна сумме атомных масс веществ, входящих в состав молекулы. Поэтому:
M r ( H 2 S O 4 ) = 1 · 2 + 32 + 16 · 4 = 98 г / м о л ь
Решение химических задач по нахождению абсолютной массы может сводиться к использованию следующих методов:
При этом молярную массу можно найти путем сложения атомных масс элементов, входящих в состав соединения. Молярная масса находится также как отношение массы вещества к его соответствующему количеству:
Масса атомов и молекул
Атомная единица массы
| Атомная единица массы (а.е.м.) = 1/12 части массы атома углерода |
Относительная атомная масса кислорода будет равна:
Это значит, что масса одного атома кислорода примерно в 16 раз больше 1/12 части массы атома углерода 12 C.
| Относительная атомная масса = отношению массы атома элемента к а.е.м. |
Относительная молекулярная масса
Поскольку молекулы вещества состоят из отдельных атомов, все вышесказанное будет справедливо и для молекулярных масс (абсолютных и относительных).
Абсолютная масса молекулы (mмолекулы) будет равна сумме абсолютных масс атомов, входящих в нее. На практике же, как правило, пользуются относительной молекулярной массой (Мr), которая складывается из относительных атомных масс всех атомов, входящих в молекулу:
Абсолютная масса молекулы воды mмолекулы (H2O) будет равна:
Относительная масса молекулы воды Мr:
| Относительная молекулярная масса = отношению абсолютной массы одной молекулы вещества к а.е.м. |
Относительная молекулярная масса показывает во сколько раз масса 1 молекулы вещества больше 1/12 части массы атома углерода 12 C.
В приведённом выше примере показано, что масса одной молекулы воды в 18 раз больше 1/12 части массы атома углерода или 1 а.е.м.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Относительная атомная масса элемента
Абсолютные массы атомов Одним из фундаментальных свойств атомов, является их масса. Абсолютная (истинная) масса атома – величина чрезвычайно малая. Взвесить атомы на весах невозможно, поскольку таких точных весов не существует. Их массы были определены с помощью расчетов.
Например, масса одного атома водорода равна 0,000 000 000 000 000 000 000 001 663 грамма!
Масса атома урана – одного из самых тяжелых атомов, составляет приблизительно 0,000 000 000 000 000 000 000 4 грамма. Записывать и читать эти числа непросто; можно ошибиться, пропустив ноль или добавить лишний. Существует другой способ записи – в виде произведения: 4 ∙ 10−22 (22 – количество нулей в предыдущем числе).
Точное значение массы атома урана – 3,952 ∙ 10−22 г, а атома водорода, самого легкого среди всех атомов, – 1,673 ∙ 10−24 г. Производить расчеты с малыми числами неудобно. Поэтому вместо абсолютных масс атомов используют их относительные массы.
Относительная атомная масса
О массе любого атома можно судить, сравнивая ее с массой другого атома (находить отношение их масс). С момента определения относительных атомных масс элементов использовались различные атомы в качестве сравнения. Своеобразными эталонами для сравнения в свое время были атомы водорода и кислорода.
Единая шкала относительных атомных масс и новая единица атомной массы, принята Международным съездом физиков (1960) и унифицирована Международным съездом химиков (1961). По сегодняшний день эталоном для сравнения является 1/12 часть массы атома углерода. Данное значение называют атомной единицей массы, сокращенно а.е.м
Атомная единица массы (а.е.м.) – масса 1/12 части атома углерода
Сравним, во сколько раз отличается абсолютная масса атома водорода и урана от 1 а.е.м., для этого разделим эти числа одно на другое:
Полученные при расчетах значения и являются относительными атомными массами элементов – относительно 1/12 массы атома углерода.
Так, относительная атомная масса водорода приблизительно равна 1, а урана – 238. Обратите внимание, что относительная атомная масса не имеет единиц измерения, так как при делении единицы измерения абсолютных масс (граммы) сокращаются. Относительные атомные массы всех элементов указаны в Периодической Системе химических элементов Д.И. Менделеева. Символ, при помощи которого обозначают относительную атомную массу – Аr (буква r – сокращение от слова relative, что означает относительный).
Значения относительных атомных масс элементов используются во многих расчетах. Как правило, значения, приведенные в Периодической Системе, округляются до целых чисел. Обратите внимание, что элементы в Периодической Системе размещены в порядке увеличения относительных атомных масс. Например, при помощи Периодической Системы определим относительные атомные массы ряда элементов:
Ar(Na) = 23;
Относительную атомную массу хлора принято записывать равной 35,5!
§ 1.3. Размеры атомов разных химических элементов, их абсолютные и относительные массы
Мы уже знаем, что атомы химических элементов могут отличаться друг от друга по составу и, очевидно, что это должно влиять на их массу, поскольку чем больше в ядре атома суммарное количество протонов и нейтронов, тем он тяжелее. Электроны практически не влияют на массу атома, поскольку обладают крайне малой по сравнению с нейтронами и протонами массой (mp/me
Так как количество протонов в каждом атоме всегда равно количеству электронов, а электроны, если рассматривать строение атома упрощенно, движутся вокруг ядра на значительном от него удалении, то радиус атома равен радиусу орбиты наиболее удаленного от ядра электрона. Следовательно, должна быть некоторая зависимость радиуса атома от количества таких орбит, которая в какой-то степени связана с количеством электронов.
99 %). Одну двенадцатую массы атома данного изотопа углерода было принято обозначать 1 а.е.м., что расшифровывается как «атомная единица массы». Одна атомная единица массы равно примерно 1,66·10 −27 кг.
Графическое представление смысла одной атомной единицы массы представлено на рисунке 2.

Таким образом, мы подошли к определению нового термина – относительной атомной массы:
Определение: относительная атомная масса химического элемента равна отношению его абсолютной массы к одной двенадцатой абсолютной массы атома углерода или к массе одной атомной единицы массы.
Относительную атомную массу обозначают символом Ar (индекс r означает сокращение от английского слова relative, что переводится как «относительный»). Таким образом, обозначив в общем виде химический элемент символом Х, мы получаем следующую формульную запись представленного выше определения:
Относительная атомная масса — величина безразмерная, так как в числителе и знаменателе находятся значения, измеряемые в одинаковых единицах массы (кг, г или др.). Согласно представленной выше формуле, например, относительная атомная масса водорода равна:
а относительная атомная масса кислорода:
В большинстве расчетных задач, с которыми приходится иметь дело химикам, используются значения относительных атомных масс, округленные до целочисленных значений, т.е. применительно к водороду и кислороду:
Следует отметить, что атомную массу хлора округляют до 35,5. Это связано с тем, что у данного элемента наиболее распространенные в природе изотопы имеют относительные атомные массы 35 и 37, а их содержание в смеси близко к 3:1 в пользу более легкого.